193-肿瘤信息学知识
刘小泽写于2020.6.3
从花花的书架偶然看到一本《肿瘤信息学》,没想到正好补充了自己相关领域的知识,也推荐给你。这是我整理的第一章的知识点,和原文顺序是不一致的 癌症必须被视为一个不断进化的生态系统,该系统能持续地适应氧气和营养供应的变化
1 癌症生物学基础
- 脊椎动物早期发育过程中,胚胎干细胞能分化出三个胚层:外、中、内。这三个胚层逐步分化,产生200种以上的细胞类型,构成各种组织器官和支持结构。
- 人体组织分为4大类:上皮、结缔、肌肉、神经,这些都可能形成恶性肿瘤
- 之前认为癌症是基因病,但后来支持癌症源于细胞和微环境的紊乱
- 癌症是高度异质性(同一群体中的个体差异明显)的疾病,即使同一类型的癌症,起源也可能存在巨大差异。一个给定的肿瘤很可能是一个占主导地位的克隆和几个亚克隆组成,每个克隆可能有不同的生长速度,对治疗的反应也不同
- 癌症是恶性肿瘤的一种最常见形式,起源于上皮细胞,与邻近细胞和ECM相互结合【关于癌症与恶性肿瘤的区别:实体恶性肿瘤包括癌(carcinomas)和肉瘤(sarcomas) 癌(carcinomas)指的是在细胞内生成的癌症,这些细胞是组织内层器官(tissue lining organs)的组成,如:肝脏或肾脏 肉瘤(sarcomas)则是指身体结缔组织(connective tissues)中形成的癌症,例如:在肌肉、骨骼和神经中的癌症。 而良性肿瘤不会在身体内扩散或游离。大多数良性肿瘤都不具有致命性,但是有些脑部肿瘤仍可以引发炎症,并在肿瘤周围的娇嫩组织上形成压力。
癌症和肿瘤的区别 - Dana-Farber Cancer Institute | Boston, MA
- 多样性和复杂性是癌症基因组的特征性标志(hallmark):来源于同一类型的肿瘤,也可以携带不同的遗传学改变,促进其无限扩张并最终转移
- 克隆:体细胞进行无性繁殖,以及由无性繁殖形成的基因型完全相同的后代个体组成的种群
- 驱动突变(driver)与乘客突变(passenger):driver指突变在肿瘤形成中有主导作用;passenger指非主导、伴随性作用。passenger的累积也会对肿瘤产生重要影响,可能会减慢甚至终止肿瘤生长
- P53基因:人类最早发现的抑癌基因之一。位于chr 17 p13.1,编码核内磷酸化蛋白(p53蛋白)。在SDS凝胶电泳中测得的分子质量约53kDa。该基因是细胞生长周期的负调节因子,与细胞周期调控、DNA修复、细胞分化、细胞凋亡有关
- 实体肿瘤平均有33-66个非同义的体细胞突变,主要是单碱基突变
- 约有140个类似的基因,如果突变可导致癌症,涉及启动、增殖和存活的任一过程
- 实体瘤中的免疫细胞主要是肿瘤相关的巨噬细胞(TAMs)
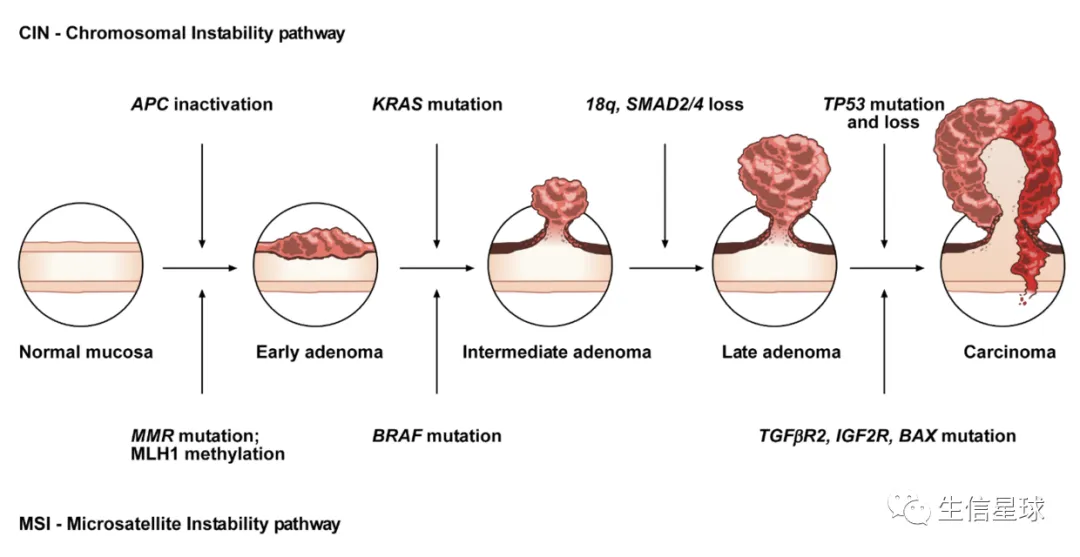
- 早期解释癌症发展:序贯模型,又称为经典通路(canonical pathway)——引入基因突变可致癌的概念,认为癌症源于线性发生的遗传改变。目前认为序贯模型更多是辅助癌细胞的发展 =》 正在经历自然选择的癌细胞,用这个模式来获得全基因组背景的支持,从而实现永生化 【图片来自文章:The Molecular Hallmarks of the Serrated Pathway in Colorectal Cancer.】 腺癌突变顺序:早期腺瘤 APC-> 中间性腺瘤 KRAS-> 腺瘤后期和腺癌 P53, DCC
Warburg 效应:20世纪20年代,Otto Warburg发现癌细胞会比正常细胞消耗更多的葡萄糖,并通过糖酵解转化为乳酸。即使在有氧条件下,癌细胞还是选择了看似”低效“的无氧糖酵解的方式。 因为:
1.厌氧发酵比有氧呼吸产生ATP的速度要快,因为只需要较少的反应步骤;
2.糖酵解可以通过磷酸戊糖途径产生DNA合成的原料
3.乳酸本身能通过各种机制促进肿瘤血管生成、细胞迁移,并逃避免疫监视
4.乳酸增加会降低细胞外的PH值。本来猜想,乳酸增加细胞内的pH应该下降,但实际上细胞内pH从正常(约7.2)增加至7.4或更高 =》 可能由于质膜相关的酸性转运体(包括氢离子-ATP酶、NHEI、氢离子-单羧酸转运体等)表达升高=》 细胞内偏碱性会增强糖酵解、促进细胞生长和转移、抑制细胞凋亡;细胞外偏酸性导致邻近的正常细胞发生凋亡,也抑制了免疫系统,有利于癌细胞生存
人们开始逐渐对Warburg效应进行重新思考和评价,并意识到代谢紊乱很可能是癌症发生发展中的驱动性因素,而此前人们认为代谢异常不过是基因突变的结果。代谢因素由”果“向”因“转换
慢性炎症可能会引发癌症,如乙肝能引发肝癌;炎癌转换的过程中许多信号通路都失去了监控,并导致了与癌症形成有关的促炎性基因的表达。缺氧、炎症和癌症有着千丝万缕的联系。实体瘤常常缺氧,同时也具有某些炎症的特点;另外,低氧使ROS升高并下调DNA的修复机制。
细胞外基质(ECM):它是组织细胞的基础。就像磁铁,可以紧紧地吸引多种被释放到细胞外空间的生长因子,保护他们不被轻易降解。当组织受到损伤时,受损的ECM就能释放之前存储的生长因子,从而促进组织再生和修复。 另外ECM要与细胞内部联系,需要靠整合素。不同的整合素可以优先识别相应的ECM成分。
间质成纤维细胞:癌症与正常组织的成纤维细胞存在差异。癌症相关的可以对转换的上皮细胞产生应答,生成更多的蛋白酶、生长因子和胶原;作用于成纤维细胞的转化生长因子β(TGFβ)的减少可以促进癌症形成
2 癌症8种特征性标志
2000年有6种,2011年扩增至8种
- 持续存在的细胞增殖信号:透明质酸片段(原本用于组织修复的促生长信号)、持续激活生长因子受体(原本在细胞分裂中持续激活)
- 躲避生长抑制因子:为了保持分裂,就要躲避某些细胞周期的负调节子,如抑癌基因RB(视网膜母细胞瘤)、P53,分别相应细胞外和内的信号。另外还有细胞外基质(ECM),由高弹性变为较致密的状态,生长因子功效可以增加100倍
- 阻止细胞凋亡: 细胞凋亡包括一系列细胞活动,包括质膜破损、细胞体积缩减、线粒体肿胀和染色质碎片化 参与细胞凋亡的两大通路分别是:内源性级联反应和外源性级联反应;此外,还有一条所谓的第三条通路,能被自然杀伤(NK)细胞和细胞毒性T淋巴细胞激活。 **促凋亡成员:**BAX、BAK是两种重要的线粒体膜蛋白,作用是:破坏线粒体膜=》释放细胞色素c=》启动凋亡=》引起caspases活化(半胱天冬氨酸蛋白酶)=》促进多种效应子的生成释放 **抗凋亡成员:**BCL2蛋白家族的BCL2、BCLB、MCL1等;PI3K-AKT/PKB通路激活;过表达生存素(它是caspase的抑制剂)
- **细胞永生化:**影响端粒酶,维持端粒长度 端粒:染色体末端,六核苷酸的重复序列,随细胞分裂不断缩短,直到细胞衰老死亡 端粒酶:为染色体增加这种保护作用的重复序列,但酶的表达水平会随着分裂次数增加而减少
- 转移:【很像殖民侵略者的逻辑,殖民侵略成功一定有卖国贼里应外合。敌军先先疏通内外关系,然后规划路线派兵出击,最后占领殖民】 脱离与其他细胞和ECM的相互作用(E-钙粘蛋白下调)=》 与肿瘤相邻的基质细胞,相应癌细胞的信号,分泌蛋白促进侵袭 (上皮-间质转化 EMT)=》 癌细胞对凋亡的抑制 =》 细胞间连接松散的转化细胞进入到附近的血管和淋巴管,输送到远端进行克隆增殖定植(colonization)=》新部位继续生长 转移占据癌症患者死因的90%
- 诱导血管生成:从已有的血管上长出新的血管,用于输送氧、营养素给原发性、继发性肿瘤(转移性肿瘤) 这个过程受血管内皮生长因子A(VEGFA)调控,通过酪氨酸激酶受体持续促进心血管生成。 血管生成在正常人并不活跃,因为受到血小板反应素-1的抑制
- 逃避免疫系统:免疫分为两种,固有免疫和获得性免疫 癌症可以对抗辅助性T细胞和自然杀伤细胞
- 重塑能量代谢:见上面👆Warburg 效应
3 原癌基因、癌基因、抑癌基因
原癌基因 =》 癌基因 《= 抑癌基因
之前认为:原癌基因是涉及细胞生长和分化的基因,它必须发生突变或过表达才能形成癌基因 后来发现:癌基因是由于能帮助癌细胞持续增殖和生存而被选择出来的,是癌进化过程中的变异
认识发生转变的故事:
20世纪早期Peyton Rous发现了一种鸟类逆转录病毒癌基因,切取肿瘤,经过处理后做成液体注入无瘤鸡,发现长出肉瘤 =》 后来传染性的成分得到鉴定,命名为Rous肉瘤病毒(RSV)=》 发现有一个高度保守的关键基因SRC(原癌基因)发生突变,而该基因编码一种调节细胞生长的酪氨酸激酶,突变导致基因产物持续表达 原癌基因到癌基因:
- 点突变:如生长因子受体或SRC=》细胞周期正向调节因子功能上调
- 染色体不稳定:如染色体部分缺失或重排(倒置、易位、插入、缺失),例如chr9的ABL基因与chr22的BCR基因融合,产生BCR-ABL融合蛋白
- 基因扩增:导致促细胞分裂的生长因子受体的表达异常增高,如乳腺癌的HER2受体
- 病毒感染:如人乳头状瘤病毒(HPV)导致宫颈癌
抑癌基因:在细胞无法满足监测点条件时(如检测到DNA损伤或损伤未被修复),组织细胞周期进程。一开始认为只有一个基因的两个等位基因位点均受到变异或损伤时,基因的正常表达和功能才完全丢失,后来发现,抑癌基因的一个等位基因位点的变异也可产生类似癌基因的致病作用。人类第一个被发现的抑癌基因是Rb1基因(1984年)
- **RB抑癌基因:**编码细胞分裂的负调控核蛋白=》核蛋白与转录因子E2F结合,使细胞一直处于G1期 =》 某些条件下(如CDK复合体活化导致RB基因过度磷酸化),RB-E2F复合物解离=》E2F上调自身及DNA复制相关酶的表达 =》 G1期(间期的DNA合成前期)步入S期(间期的DNA合成期),启动DNA合成
- **P53抑癌基因:**负责监控DNA完整度 ,激活DNA修复基因。就像管家一样,调控细胞由G1期进入S期。它能促进DNA损伤的修复(如复制错误或环境压力下的DNA损伤);如果修复失败,会终止细胞周期,引导细胞凋亡
- 在S期=》G2期(间期的DNA合成后期)、G2期=》M期(有丝分裂期),存在检测点和抑制点
- RB和P53是细胞分裂的最后关键控制点=》它们的突变会导致细胞的持续分裂和受损DNA的转录=》经常在各种癌症中检测到RB和P53基因突变
4 癌症分级分期
首先诊断:
乳房X射线检查、正电子发射断层扫描(PET)、磁共振成像(MRI)、某些情况下的影像学分析和生物标志物检测,如血液循环中的前列腺特异性抗原(PSA)的浓度=》最终诊断依赖于活检(biopsy)或切除组织的病理检查
**然后取材:**取材标本经过良、恶性鉴定之后再进行分级
分级:
- 含义:癌细胞与正常细胞的(大小,形状和染色特性)相似性。肿瘤细胞看起来更像正常细胞,则称为高分化(G1)= 低级别,其分裂速度较慢。级别越低,说明癌细胞越像正常细胞,预后也越好。
- 目的:对如何出现异常细胞进行评定
- 方法:对取材标本的大体检查、免疫组化检查特异性标志物(如在乳腺癌中检测雌激素受体表达水平)
- 标准:GX表示级别无法确认;大多数癌症分为4级(前列腺癌有其他方法)。G1是分化良好(低级);G2是中度分化(中级);G3是低分化(高级);G4是未分化(高级)
分期:
- 目的:评估个体所患癌症的严重度,不同分期治疗方案不同,预后不同
- 因素:肿瘤大小和位置、淋巴结受累情况、细胞类型、是否转移
- 标准:
- TNM分期之T:肿瘤的程度
- Tx:无法评估的原发肿瘤
- T0:无法找到的原发肿瘤
- Tis:原位癌,局灶异常细胞没有扩散到其他位置
- T1、T2、T3、T4
- TNM分期之N:癌细胞是否波及附近淋巴结
- Nx:无法评估
- N0:邻近淋巴结未受累及
- N1、N2、N3根据受累淋巴结的数目分期
- TNM分期之M:癌症是否发生转移
- Mx:无法评估的转移
- M0:没有转移
- M1:已发生转移
- TNM分期之T:肿瘤的程度